こんにちは、今回は「ベンリスタ®︎(ベリムマブ)のSLEに対するエビデンス」について取り上げていきたいと思います。
私も以前からベンリスタ®︎を使っていましたが、どういった症状に有効性があるのか気になっていました。よろしくお願いします。
ベンリスタのエビデンスについて

今回は、特に北東アジア(中国、韓国、日本)のSLE(全身性エリテマトーデス)患者さんに対するベンリスタ®︎(べリムマブ)のエビデンスについて紹介します。
参考にする論文は、2018年にAnnals of the Rheumatic Disease(IF ≒ 19.1)に掲載された『 A pivotal phase III, randomised, placebo-controlled study of belimumab in patients with systemic lupus erythematosus located in China, Japan and South Korea1) (BLISS-NEA:North East Asia)』です。

もともとベンリスタ®︎(ベリムマブ)が商品開発されるきっかけとなったべリムマブの臨床試験であるBLISS-56、BLISS-SC、BLISS-76試験において、SLEの疾患活動性の有意な改善をに加えて、ステロイドの減量効果があることが示されています2-4)。
しかし、これらの試験は中国、韓国、日本といった北東アジアのSLE患者さんが少なかったため、今回の結果は、これまでの試験よりもより日本人の有効性について参考となる結果となります。
方法 Methods

まずは、試験の方法について簡単に見ていきます。
試験概要
- 試験デザイン:第Ⅲ相、多施設共同、無作為化二重盲検プラセボ対照試験
- 施設:中国、日本、韓国の49施設(2011年5月~2015年9月)
- 割り付け:SLE患者さん(677人)を、ベリムマブ(ベンリスタ®︎)10mg/kg または プラセボの静脈内投与と標準治療に 2:1に無作為に割り付け、48週まで4週毎に投与された。
- 組み入れ基準:
- 18歳以上
- ACR改定分類基準(1997年)を満たしたSLE患者
- SELENA-SLEDAIスコアが8以上の活動性があるSLE患者
- 抗核抗体陽性
- ベースライン前の30日以上、安定したSLE治療を受けていること
- 割り付け(365人):アニフロルマブ(サフネロー®︎) 300mg/4w 群 (181人)とプラセボ群(184人)に1:1に割り付けられた。
- 急性治療を要する重症または活動性ループス腎炎がある
- 急性治療を要する中枢神経系(CNS)ループスがある
- ベースライン前60日以内にステロイド以外の新しい治療薬が使用された
- 主要評価項目
- 『 52週目におけるSRI(SLE Responder Index)4の反応率 』
- 副次評価項目
- SELENA-SLEDAI(Safety of Oestrogens in Lupus Erythematosus National Assessment-SLE Disease Activity Index)が4点以上減少した患者の割合
- SRI7(SELENA-SLEDAIが7点以上低下した患者の割合)
- 初回重度の再燃までの時間
- プレドニゾロン(または同等)の用量が7.5mg/日以下 および/または ベースラインから50%減少した日数
SRI4とは
SRI(SLE Responder Index)4とは、SELENA、SLEDAI、BILAG、PGAから構成される、SLEの病態の悪化を伴わない疾患活動性を評価する尺度です。
- SELENA、SLEDAI:いずれもSLEの 全般的な疾患活動性の低下を評価する指標です。
- BILAG:SLE患者さんの特定臓器で意義のある悪化がないことを評価する指標です。
- PGAは、医師による全般的な疾患活動性評価です。
ベースライン(開始時)の患者さんの特性

では、2群間のベースライン(開始時)の特性を見てみましょう。
以下のように両群間でベースラインの特性は類似していました。
| 特徴 mITT population | べリムマブ群 (ベンリスタ®︎) n=451 | プラセボ群 n=226 |
| 国 | ||
| 中国 | 346(76.7%) | 171(75.7%) |
| 韓国 | 66(14.6%) | 34(15%) |
| 日本 | 39(8.6%) | 21(9.3%) |
| 女性 | 419(92.9%) | 210(92.9%) |
| 年齢,平均(SD) | 32.3歳(9.65) | 31.7歳(9.18) |
| SLEの罹患期間(年),平均(SD) | 6.07年(5.04) | 5.97(5.19) |
| SELENA-SLEDAI 項目 | ||
| ≦9 | 48.3%(218) | 45.1%(102) |
| ≧10 | 51.7%(233) | 54.9%(124) |
| SLENA-SLEDAIスコア,平均(SD) | 9.8(3.83) | 10.2(4.11) |
| SLEの併用薬 | ||
| ステロイド | 98.2%(443) | 98.7%(223) |
| ヒドロキシクロロキン (プラケニル®︎) | 71%(320) | 69.5%(157) |
| アザチオプリン (アザニン®︎/イムラン®︎) | 10.6%(48) | 6.6%(15) |
| レフルノミド (アラバ®︎) | 10.2%(46) | 8.4%(19) |
| メトトレキサート | 6.4%(29) | 6.6%(15) |
| ミコフェノール酸モフェチル (セルセプト®︎) | 28.8%(130) | 33.2%(75) |
| 漢方薬-芍薬甘草湯/白虎加竜骨牡蛎湯 | 13.1%(59) | 13.7%(31) |
| 安全性集団 | n=470 | n=235 |
| 抗dsDNA抗体陽性(≧30 IU/mL) | 81.9%(385) | 79.1%(186) |
| 抗核抗体陽性(≧80倍) | 100%(470) | 99.6%(234) |
| 低C3(<90 mg/dL) | 73.2%(344) | 69.4%(163) |
| 低C4(<10 mg/dL) | 29.6%(139) | 32.8%(77) |
結果 Results

それでは、結果はどうだったのでしょうか。
主要評価項目:Primary End Point
❶ SRI4反応率はどうでしたか?
主要評価項目であるSRI4反応率は、べリムマブ(ベンリスタ®︎)群がプラセボ群よりも高かったという結果でした。
※ SRI4;SLEの病態の悪化を伴わない疾患活動性を評価する尺度
| 52週時 | べリムマブ群 (ベンリスタ®︎) | プラセボ群 |
| SRI4反応率 | 53.8 % | 40.1% |
| OR:1.99(95% CI:1.40, 2.82) | p = 0.0001 |
また、プラセボと比較して12週目の早い段階からべリムマブの有意差が認められています。

副次評価項目:Secondary End Point
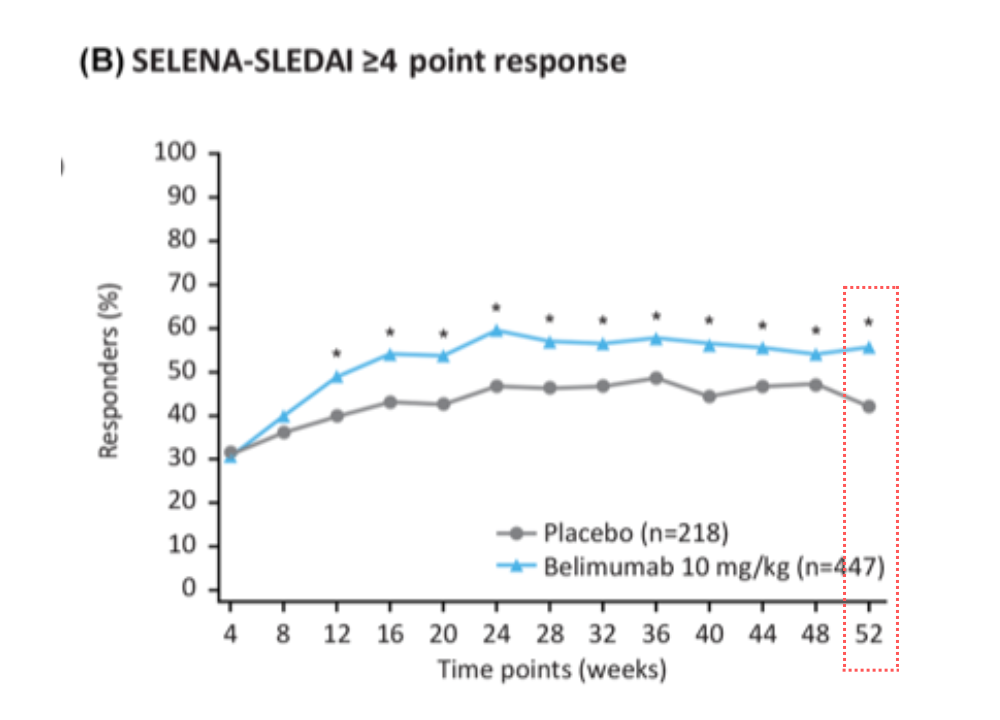
❷ SELENA-SLEDAI が4点以上減少した患者の割合はどうでしたか?
SELENA-SLEDAIが4点以上減少した割合は、プラセボ群に対してベンリスタ®︎(べリムマブ)群で有意に高く、ベンリスタ®︎(べリムマブ)の併用によって活動性が低下していることがわかります。
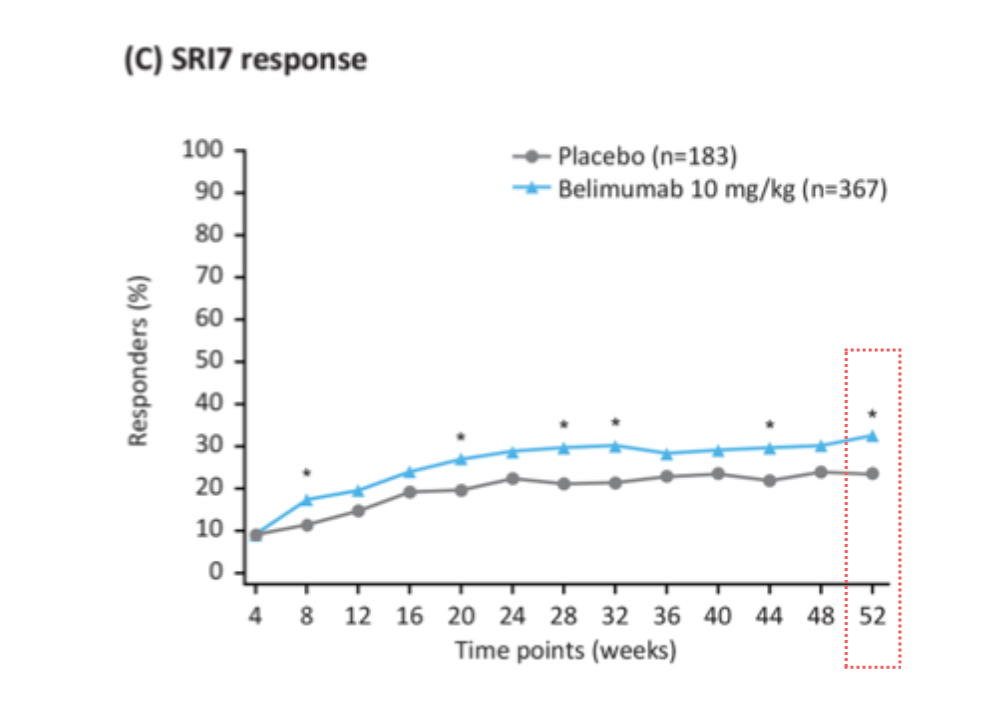
❸ SRI7反応率はどうでしたか?
ベリムマブ(ベンリスタ®︎)群はプラセボ群と比較して、投与開始後52週目にSRI7(SELENA-SLEDAIが7点以上低下)を達成した患者さんが多く、ベンリスタ®︎(べリムマブ)の併用によってSELENA-SLEDAIが7点以上低下することも期待できます。
| 52週時 | べリムマブ群 (ベンリスタ®︎) | プラセボ群 |
| SRI7反応率 | 32.4 % (119/367) | 23.5% (43/183) |
| OR 1.76(95% CI: 1.13, 2.74) | p = 0.0116 |
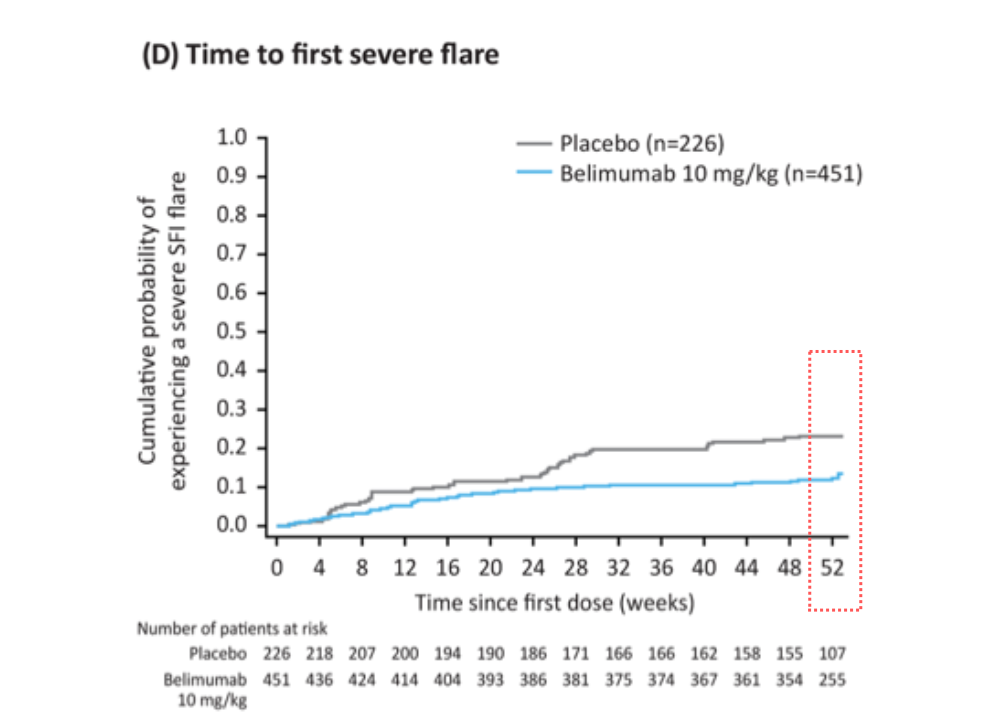
❹ 初回重度の再燃までの時間はどうでしたか?
ベリムマブ(ベンリスタ®︎)群ではプラセボ群に比べ、重度の再燃(フレア)を経験した患者さんの割合が低く(12.0%(54/451) vs 22.1%(50/226)) 、重度の再燃が発生するリスクが50%低くなっていました(p =0.0004)。

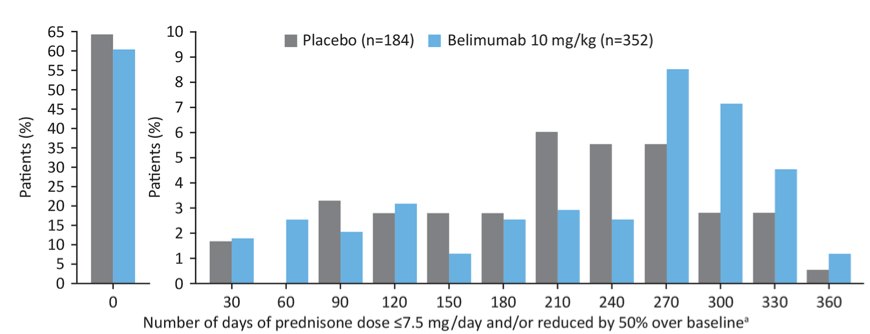
❺ ステロイドの減量効果はありましたか?
ベースライン(開始時)のプレドニゾロン投与量が7.5mg/日を超えている患者さんでは、ベリムマブ群の方がプラセボ群よりもステロイド使用量の有意な減少が認められました(P=0.0228)。
プレドニゾロン 7.5mg/日以下および/または50%減少した日数の中央値は両群とも0でしたが、75パーセンタイルはプラセボ群に比べてベリムマブ群で大きく(213.5日 vs 172.0日)、ベリムマブ群でより長い期間、ステロイドの減少が認められました。
| 52週時 | べリムマブ群 (ベンリスタ®︎) n=451 | プラセボ群 n=226 |
| ベースライン(開始時)のプレドニゾロンの平均投与量 mg/日(SD) | 16.0mg/日(10.66) | 17.2 mg/日(10.82) |
| 52週時のプレドニゾロンの累積投与量 mg,中央値(25、75パーセンタイル) | 4190mg (3090、5475) | 4758 mg (3598、6695) |
| p = 0.0005 有意差あり | ||
| ベースライン(開始時)にプレドニゾロン > 7.5mg/日の患者数 | 78%(352) | 78%(352) |
| プレドニゾロン(または同等)の用量が7.5mg/日以下 および/または ベースラインから50%減少した日数, 中央値(25、75パーセンタイル) | 0(0、213) | 0(0、172) |
| p = 0.0288 有意差あり |

❻ 特にどういった症状に有効性でしたか?
ベリムマブ(ベンリスタ®︎)はプラセボと比べて、特に① 皮膚・粘膜、② 関節症状、③ 血液障害、④ 全身症状に有意に症状改善を認めました(BILAG改善度)。
ただし、その後の試験(BLISS-LN)でループス腎炎にも有効性が示されています。

❼ 安全性はどうでしたか?
有害事象(AE)発生率は、プラセボ群とベリムマブ群でほぼ同等であり(75.7% vs 74.9%)、ほとんどの有害事象の重症度は軽度または中等度でした。
ベリムマブ群およびプラセボ群で最も多く報告された有害事象は、上気道感染症(13.8% vs 16.6%)でした。
重篤な有害事象(SAE)の発生率は、ベリムマブ(12.3%)よりもプラセボ(18.3%)の方が高く、感染性SAEは両群で同程度(それぞれ5.5%対5.3%)でした。
まとめ

- ベリムマブ(ベンリスタ®︎)は、52週時のSRI4反応率(SLEの病態の悪化を伴わない疾患活動性を評価する尺度)がプラセボと比べて有意に高かった。
- ベンリスタ®︎はステロイド、特にPSL 7.5mg以上を使用している場合にステロイドの減量効果を示した。
- ベンリスタ®︎は、重度の再燃を起こすリスクをプラセボと比べて50%低下させる。
- 安全性についてもプラセボ群と比べて大きな差はなかった。
- 皮疹、関節症状、血液障害、全身症状に特に有効性が期待される(後にループス腎炎にも有効性が示されています)。
- 以上から、寛解導入薬として有用であることが示唆される。

〈参考〉
- 1) Fengchun Zhang, et al. Ann Rheum Dis 2018;77:355-363.
- 2) Navarra SV , Guzmán RM , Gallacher AE , et al . Efficacy and safety of belimumab in patients with active systemic lupus erythematosus: a randomised, placebo-controlled, phase 3 trial. Lancet 2011;377:721–31
- 3) Furie R , Petri M , Zamani O , et al . A phase III, randomized, placebo-controlled study of belimumab, a monoclonal antibody that inhibits B lymphocyte stimulator, in patients with systemic lupus erythematosus. Arthritis Rheum 2011;63:3918–30.
- 4) Stohl W , Schwarting A , Okada M , et al . Efficacy and safety of subcutaneous belimumab in systemic lupus erythematosus: A fifty-two-week randomized, double-blind, placebo-controlled Study. Arthritis Rheumatol 2017;69:1016–27.

今回はここまでです。最後までお読み頂きありがとうございました。ご参考になりましたら幸いです? Twitterでのいいねやフォローをして頂けますと励みになりますので、ぜひよろしくお願いします?
リンク
※個人個人で症状の違いがあるため、詳細な治療などにつきましては直接医療機関へお問い合わせください。