こんにちは、今回は「SLE、APSを含むリウマチ・筋骨格系疾患と心血管リスク管理」について取り上げていきたいと思います。
リウマチ・筋骨格疾患などでは、心血管疾患にならないためどういった管理が推奨されているのか気になります。
2022年6月に欧州リウマチ学会(EULAR)より『 SLE、APSを含むリウマチ・筋骨格系疾患における心血管リスク管理の推奨事項1) 』が報告されました。
今回は、このEULARの推奨事項のポイントをご紹介していきます。

Contents
SLE、APSを含むリウマチ・筋骨格系疾患と心血管疾患の関係
SLE、APSを含むリウマチ・筋骨格系疾患における心血管疾患では、以下のことが言われています。
- 炎症性リウマチ疾患は、一般人口に比べて心血管疾患のリスクが高い2)ことが言われている。
- 痛風、血管炎、全身性硬化症(SSc)、筋炎、混合結合組織病(MCTD)、シェーグレン症候群(SS)、全身性エリテマトーデス(SLE)、抗リン脂質症候群(APS)などのリウマチ・筋骨格系疾患においても、心血管疾患の発症および死亡が高いことが報告されている3-13)。
- 慢性炎症は、リウマチ性疾患における心血管疾患発症の重要な特徴であると考えられている19)。
- 炎症のコントロールがうまくいけば、個々の患者の心血管リスクを下げることができるかもしないが23,24)、免疫抑制薬などの副作用が抗炎症効果を上回り、その結果心血管リスクを上昇させる可能性があるかどうかは不明である。
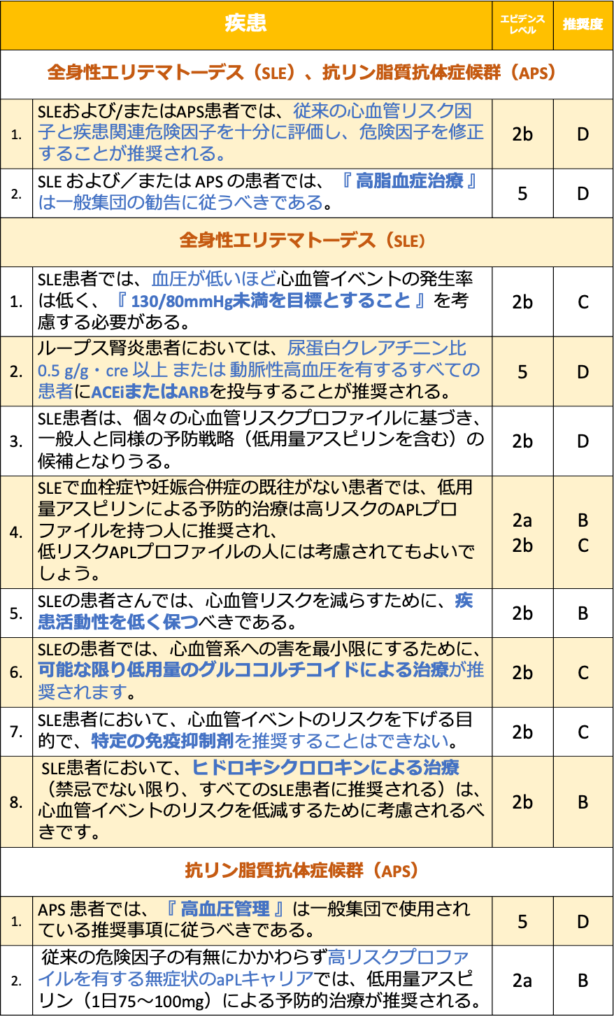
痛風、血管炎、強皮症、筋炎、MCTD、シェーグレン症候群における心血管リスク管理 一覧

SLE、APSにおける心血管リスク管理 一覧


痛風、血管炎、強皮症、筋炎、MCTD、シェーグレン症候群

それでは、個々の推奨事項について詳しく見ていきたいと思います。
❶ 痛風、血管炎、強皮症、筋炎、MCTDおよびシェーグレン症候群の患者では、従来の心血管リスク因子を徹底的に評価することを推奨する。一般集団と同様に心血管予測ツールの使用が推奨される。
- 痛風、血管炎、強皮症、筋炎、MCTD、シェーグレン症候群の患者における心血管予測ツールの精度を調査した研究はない。
- 心血管系疾患のリスク上昇が、従来の危険因子や疾患特異的危険因子の有病率の増加によってどの程度引き起こされているかは、現在のところ不明である。
❷ 痛風、血管炎、強皮症、筋炎、MCTD、シェーグレン症候群の患者では、『 血圧の管理 』は一般集団で使用される推奨事項に従うべきである。
- ある小規模なレトロスペクティブコホート研究では、βブロッカーで治療した巨細胞性動脈炎(GCA)患者において、重度の頭蓋虚血イベントが増加することを発見した42)。
- SSc(全身性強皮症)のある大規模プロスペクティブコホート研究では、心室性不整脈に対してカルシウム拮抗薬、ACE阻害薬、アンジオテンシン受容体拮抗薬による保護効果があることがわかった43)。
- 現在のところ、痛風、血管炎、強皮症、筋炎、MCTD、シェーグレン症候群の患者における高血圧治療目標値を一般集団で使用されている血圧の値から変更する根拠はない。
❸ 痛風、血管炎、強皮症、筋炎、MCTD、シェーグレン症候群の患者では、『 脂質管理 』は一般集団で使用されている推奨事項に従うべきである。
- 痛風患者において、一般集団と比較して、スタチンの心血管疾患や死亡率への影響を評価した研究はない。
- 2件のレトロスペクティブコホート研究では、痛風患者の5年後および10年後の死亡率について、スタチンを使用していない患者と比較して、スタチンの保護効果が示唆された45,46)。
- エビデンスが限られているため、一般集団の脂質管理に関するガイドラインに従うことが推奨される。
- さらに、スタチンと予防的コルヒチン(0.5mg/日)の併用による副作用としての筋毒性はまれであり、スタチンのルーチンの中止は推奨されない47)。
❹ 痛風、血管炎、強皮症、筋炎、MCTD、シェーグレン症候群の患者では、一次予防のための低用量アスピリンの標準的な使用は推奨されない。血小板阻害剤による治療は、一般集団で使用されている推奨事項に従ってください。
- 2009年 EULARは、大血管炎患者における心血管および脳血管イベントの予防のためにアスピリンの使用を推奨した(LoE:3、GoR:C)51)が、2020年 EULAR recommendationsの更新では、2009年のエビデンスを再評価し、リスクベネフィット分析が好ましくないこと、他の理由で適応とならない限り抗血小板薬の包括的使用は必須ではないと結論付けている53)。

全身性強皮症(SSc)

❶ SSc患者では、βブロッカーは避けるべきである。
- 大規模な臨床試験がないため、専門家の意見に基づくが、βブロッカーはレイノー現象に影響を与えるため禁忌と考えられる。
ANCA関連血管炎
❶ ANCA関連血管炎では、フラミンガムスコア(人の10年間の心血管疾患リスクの推定)は心血管リスクを過小評価する可能性があります。欧州血管炎学会(EUVAS)モデルからの情報は、修正可能なフラミンガムリスクファクターを補足する可能性があり、考慮することが推奨される。
- 痛風、血管炎、強皮症、筋炎、MCTD、シェーグレン症候群の患者における心血管予測ツールの精度を調査した研究はない。
- 心血管系疾患のリスク上昇が、従来の危険因子や疾患特異的危険因子の有病率の増加によってどの程度引き起こされているかは、現在のところ不明である。
❷ ANCA 関連血管炎患者において、寛解導入と寛解維持は心血管リスクを低下させることにもなる。
- 対象4試験のうち3試験で、疾患活動性スコア(Birmingham Vasculitis Activity Scores version 3)が高いことと、心血管イベントのリスクが高いことの間に関連が見られた64-66)。
巨細胞性動脈炎(GCA)
❶ GCA(巨細胞性動脈炎) 患者では、再発リスクとグルココルチコイド使用の副作用のバランスを考慮した最適なグルココルチコイドレジメンが、心血管リスク を減少させることも考慮されるかもしれない。
- GCA(巨細胞性動脈炎)では、2つの研究で、プレドニゾロンの投与量(1日/累積)が多い患者ほど、心血管リスクが高いことが報告された。
- 別の研究では、グルココルチコイドに加え、免疫抑制剤を使用することが新たな心血管イベントに対する保護因子であることが報告された67,68)。
- グルココルチコイドによる心血管リスクの上昇は、再発のリスクとバランスをとる必要がある。

痛風

❶ 痛風患者においては、利尿剤は避けるべきである。
- 痛風の管理に関するEULARの勧告に従い、チアジド系及びループ系利尿剤は、血清尿酸値を上昇させる作用があるため、可能であれば使用を避けるべきである44)。
- 代わりに、カルシウム拮抗薬またはロサルタンの使用を検討することができる。
❷ 痛風患者においては、心血管イベントと心血管死亡のリスクを低下させる可能性のある 尿酸値 6 mg/dL 以下を推奨する。
- 痛風患者を対象としたレトロスペクティブコホート研究では、尿酸値の上昇と心血管イベントの関連性が示された54,55)。この関連性は、尿酸値が 6 mg/dLより 8 mg/L 以上の患者でより強いかもしれない56,57)。
- ただし、尿酸降下療法の効果に関する研究では、矛盾する結果も示されている。エビデンスは主に観察研究から得られており、治療継続率や治療中の尿酸値に関するデータが不足していることが多い。
- ある研究では、定義された1日の投与量が最も多いグループで心血管リスクが低下するという線形用量反応関係が示された58)。
- このことは、十分な尿酸降下療法が心血管リスクを低下させる可能性を示唆している。この可能性は、それぞれ「高用量」のアロプリノールと 尿酸値 <6mg/dLの尿酸降下療法が心血管イベントと心血管死亡率に保護的な関連を示した2つの研究によって支持された59,60)。
❸ 痛風患者において、心血管系の観点から 特定の尿酸降下薬を選択することはない。
- 現在のEular guidelinesでは、アロプリノールを第一選択とし、次いでフェブキソスタットを推奨している。
- 全体として、使用量や治療期間にかかわらず、心血管イベント数に差は見られなかった61-63)。
- 2018年 CARES試験では、アロプリノールよりもフェブキソスタットの方が心血管死亡リスクが高いと報告した62)。しかし、主要複合心疾患エンドポイントに差は見られなかった。
- FAST試験では、アロプリノールまたはフェブキソスタットを使用する患者の間で心血管リスクに差がないことが示された29)。
- CARES試験の限界(脱落者数が多い、主要評価項目に差がない、ほとんどのイベントが試験中止後に発生)およびFAST試験の非劣性結果より、心血管アウトカムに関する特定の尿酸降下療法の使用は推奨されません。
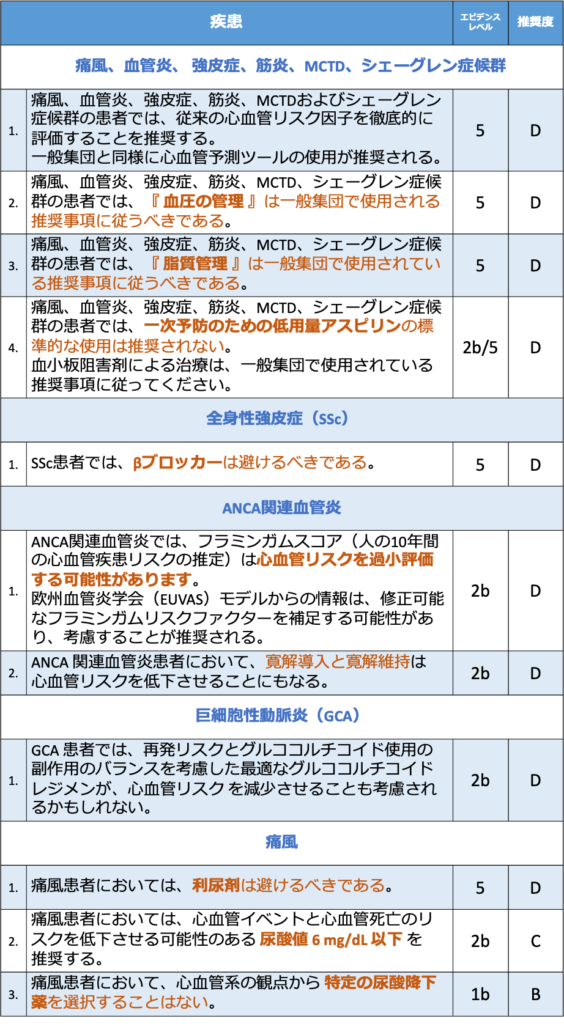
全身性エリテマトーデス(SLE)、抗リン脂質抗体症候群(APS)
❶ SLEおよび/またはAPS患者では、従来の心血管リスク因子と疾患関連危険因子を十分に評価し、危険因子を修正することが推奨される。
- 現在のエビデンスの限界を考慮し、タスクフォースは特定の心血管リスク評価ツールの使用を推奨せず、代わりに心血管疾患予防の介入を導くために従来のリスク因子および疾患関連のリスク因子を十分に評価することを推奨した。
❷ SLE および/または APS の患者では、『 高脂血症治療 』は一般集団の勧告に従うべきである。
- 国の行政データを用いたある研究では、脂質降下薬による治療を受けたSLE患者は、治療を受けなかった患者に比べて追跡期間中(平均8.4年)の冠動脈疾患のリスクが有意に低く、短期間または長期間にわたるスタチン使用は、いずれも脳卒中のリスクの低下と関連していた84)。
全身性エリテマトーデス(SLE)

❶ SLE患者では、血圧が低いほど心血管イベントの発生率は低く、『 130/80mmHg未満を目標とすること 』を考慮する必要がある。
- SLEでは,高血圧は冠動脈疾患77)と脳卒中78)の初発リスクを高めるとされている。
- 平均収縮期血圧 ≧ 132 mmHgは、心血管イベントのリスクを高める要因であり、収縮期血圧は拡張期血圧よりも強い相関がありました80)。
- SLE患者を対象にした最近の研究では、3つの血圧カテゴリー(正常血圧;収縮期血圧130-139/拡張期血圧80-89;収縮期血圧 140以上/拡張期血圧 90mmHg以上)を検討し、正常血圧群に比べ高血圧群では心血管イベントのリスクが高くなると報告しています30)。
- これは、『 130/80 未満の目標血圧 』が用いられるべきことを示唆するものである。
❷ ループス腎炎患者においては、尿蛋白クレアチニン比 0.5 g/g・cre 以上 または 動脈性高血圧を有するすべての患者にACEiまたはARBを投与することが推奨される。
- ループス腎炎では、降圧治療が心血管イベントに与える影響に特化したエビデンスは乏しい。
- レトロスペクティブコホート解析81)では、心血管イベントのリスクは ACEI/ARBによる治療とは関連がなかったが、ACEI/ARB群の18%が末期腎不全であるのに対し、比較群では2.4%で、この不均衡が心血管リスクの比較に影響を与えていると予想される。

❸ SLE患者は、個々の心血管リスクプロファイルに基づき、一般人と同様の予防戦略(低用量アスピリンを含む)の候補となりうる。
❹ SLEで血栓症や妊娠合併症の既往がない患者では、低用量アスピリンによる予防的治療は高リスクのAPLプロファイルを持つ人に推奨され、低リスクAPLプロファイルの人には考慮されてもよいでしょう。
- SLEやAPSの患者における心血管予防のための低用量アスピリンの使用は、EULAR recommendationsに従って(特に高リスクのaPLプロファイルがある場合)個別に行う必要があります。
❺ SLEの患者さんでは、心血管リスクを減らすために疾患活動性を低く保つべきである。
- SLEの活動性は、しばしば心血管イベントの予測因子として報告されている。
- 2つの研究を除いて、時間積分したSLEDAI値(SLEの疾患活動性指標)が高いほど、心血管イベントのリスクが高い69,77,79,93)。
- 3つの研究71,96,97)では、ベースラインのSLEDAIは多変量解析に持ち込まれなかったが、心血管イベントを起こした患者では高いことが分かった。
- 現在のプレドニン投与量を調整した解析では、SLEDAIの1ポイント上昇は、心血管イベントのリスク上昇とわずかに関連していた(相対リスク 1.05、95%CI 1.00~1.11)69)。
❻ SLEの患者では、心血管系への影響を最小限にするために、可能な限り低用量のグルココルチコイドによる治療が推奨されます。
- 現在使用しているグルココルチコイドの量が多いと、2つの研究でアテローム血栓性イベント、虚血性心疾患、脳卒中のリスクが高いことが示されている69,98)。
- 1日の平均投与量が多い、累積投与量が多い、プレドニゾン30mg/日以上の使用歴があることはコホート研究、ケースコントロール研究ともに一貫して心血管イベントのリスク上昇と関連していた71,92,100,101)が、トロントコホートの2つの分析では、グルココルチコイド使用は心血管イベントと有意に関連していなかった95,97)(すべての研究がSLE活動性を調整したわけではない)。
- SLEの活動性を調整したレトロスペクティブな研究98)では、1日の投与量が多い(プレドニゾロン>10mg)連続投与は、心筋梗塞と脳卒中の両方に有意に関連することがわかった。
- レトロスペクティブで非ランダムな研究では、グルココルチコイドの用量最小化戦略に従って診療を受けた患者は、プレドニゾロン曝露量が少なく、SLICC指標による心血管障害のリスクが著しく低く、特に脳卒中が低かった102)。
- ほとんどのエビデンスから、グルココルチコイド曝露(累積および平均日量)が多いとSLEの心血管リスクが増加すると考えられている。
❼ SLE患者において、心血管イベントのリスクを下げる目的で、特定の免疫抑制剤を推奨することはできない。
- トロントのループスコホートの3つの研究では、免疫抑制剤と心血管イベントとの関連は保護的96)96 または無効93,97)であった一方、ある研究では、単変量解析で免疫抑制剤治療を受けた患者は受けなかった患者より心血管イベントを発症しやすかった95)。
- LUMINA104)とHopkins69)のループスコホートでは、免疫抑制療法は虚血性心疾患と心血管イベントの高いオッズと関連していた。
❽ SLE患者において、ヒドロキシクロロキンによる治療(禁忌でない限り、すべてのSLE患者に推奨される)は、心血管イベントのリスクを低減するために考慮されるべきです。
- SLEの心血管系予防における抗マラリア薬の役割については、多くのエビデンスが報告されている。
- 6つのコホート研究において、抗マラリア薬の使用は、アテローム血栓性イベントまたは冠動脈疾患のリスク低下と関連していました69,77,79,88,94,107。
- しかし、別の研究では、保護は現在の長期使用としか関連性がなかった87,92,93,95,103,106)。
- 7件の症例対照研究のうち2件では、心血管系イベントを発症した症例では、対照群に比べてヒドロキシクロロキンの使用量が少ないと報告している100,108)。
抗リン脂質抗体症候群(APS)

❶ APS 患者では、『 高血圧管理 』は一般集団で使用されている推奨事項に従うべきである。
- APS 患者における心血管予防のための特定の降圧剤の使用に関する研究は確認されていない。これらの患者は、一般集団に対する推奨事項に従って管理されるべきである82)。
❷ 従来の危険因子の有無にかかわらず高リスクプロファイルを有する無症状のaPLキャリアでは、低用量アスピリン(1日75~100mg)による予防的治療が推奨される。
- SLEやAPSの患者における心血管予防のための低用量アスピリンの使用は、EULAR recommendationsに従って(特に高リスクのaPLプロファイルがある場合)個別に行う必要があります。

〈参考〉
- 1) George C Drosos, et al. Ann Rheum Dis 2022;81:768-79.
- 2) England BR, et al. Increased cardiovascular risk in rheumatoid arthritis: mechanisms and implications. BMJ 2018;361:k1036.
- 3) Clarson LE, Chandratre P, Hider SL, et al. Increased cardiovascular mortality associated with gout: a systematic review and meta-analysis. Eur J Prev Cardiol 2015;22:335–43.
- 4) Kuo C-F, Yu K-H, See L-C, et al. Risk of myocardial infarction among patients with gout: a nationwide population-based study. Rheumatology 2013;52:111–7.
- 5) Alenghat FJ. The prevalence of atherosclerosis in those with inflammatory connective tissue disease by race, age and traditional risk factors. Sci Rep 2016;6:20303.
- 6) Aouba A, Gonzalez Chiappe S, Eb M, et al. Mortality causes and trends associated with giant cell arteritis: analysis of the French national death certificate database (1980-2011). Rheumatology 2018;57:1047–55.
- 7) Houben E, Penne EL, Voskuyl AE, et al. Cardiovascular events in anti-neutrophil cytoplasmic antibody-associated vasculitis: a meta-analysis of observational studies. Rheumatology 2018;57:555–62.
- 8) Zöller B, Li X, Sundquist J, et al. Risk of subsequent ischemic and hemorrhagic stroke in patients hospitalized for immune-mediated diseases: a nationwide follow-up study from Sweden. BMC Neurol 2012;12:41.
- 9) Zöller B, Li X, Sundquist J, et al. Risk of subsequent coronary heart disease in patients hospitalized for immune-mediated diseases: a nationwide follow-up study from Sweden. PLoS One 2012;7:e33442.
- 10) Tektonidou MG, Lewandowski LB, Hu J, et al. Survival in adults and children with systemic lupus erythematosus: a systematic review and Bayesian meta-analysis of studies from 1950 to 2016. Ann Rheum Dis 2017;76:2009–16.
- 11) Cervera R, Serrano R, Pons-Estel GJ, et al. Morbidity and mortality in the antiphospholipid syndrome during a 10-year period: a multicentre prospective study of 1000 patients. Ann Rheum Dis 2015;74:1011–8.
- 12) Houben E, Mendel A, van der Heijden JW, et al. Prevalence and management of cardiovascular risk factors in ANCA-associated vasculitis. Rheumatology 2019;58:2333–5.
- 13) Cen X, Feng S, Wei S, et al. Systemic sclerosis and risk of cardiovascular disease: a PRISMA-compliant systemic review and meta-analysis of cohort studies. Medicine 2020;99:e23009.
- 19) Manzi S, Wasko MC. Inflammation-Mediated rheumatic diseases and atherosclerosis. Ann Rheum Dis 2000;59:321–5.
- 23) Ajala ON, Everett BM. Targeting inflammation to reduce residual cardiovascular risk. Curr Atheroscler Rep 2020;22:66.
- 24) Lawler PR, Bhatt DL, Godoy LC, et al. Targeting cardiovascular inflammation: next steps in clinical translation. Eur Heart J 2021;42:113–31.
- 42) Grossman C, Barshack I, Koren-Morag N, et al. Risk factors for severe cranial ischaemic events in patients with giant cell arteritis. Clin Exp Rheumatol 2017;35 Suppl 103:88–93.
- 43) Valentini G, Huscher D, Riccardi A, et al. Vasodilators and low-dose acetylsalicylic acid are associated with a lower incidence of distinct primary myocardial disease manifestations in systemic sclerosis: results of the DeSScipher inception cohort study. Ann Rheum Dis 2019;78:1576–82.
- 44) Richette P, Doherty M, Pascual E, et al. 2016 updated EULAR evidence-based recommendations for the management of gout. Ann Rheum Dis 2017;76:29–42.
- 45) Garcia-Gil M, Comas-Cufí M, Ramos R, et al. Effectiveness of statins as primary prevention in people with gout: a population-based cohort study. J Cardiovasc Pharmacol Ther 2019;24:542–50.
- 46) Keller SF, Rai SK, Lu N, et al. Statin use and mortality in gout: a general population- based cohort study. Semin Arthritis Rheum 2018;48:449–55.
- 47) Finkelstein Y, Aks SE, Hutson JR, et al. Colchicine poisoning: the dark side of an ancient drug. Clin Toxicol 2010;48:407–14.
- 51) Mukhtyar C, Guillevin L, Cid MC, et al. EULAR recommendations for the management of large vessel vasculitis. Ann Rheum Dis 2009;68:318–23.
- 53) Hellmich B, Agueda A, Monti S, et al. 2018 update of the EULAR recommendations for the management of large vessel vasculitis. Ann Rheum Dis 2020;79:19–30.
- 54) Chen J-H, Lan J-L, Cheng C-F, et al. Effect of urate-lowering therapy on all-cause and cardiovascular mortality in hyperuricemic patients without gout: a case-matched cohort study. PLoS One 2015;10:e0145193.
- 55) Perez-Ruiz F, Martínez-Indart L, Carmona L, et al. Tophaceous gout and high level of hyperuricaemia are both associated with increased risk of mortality in patients with gout. Ann Rheum Dis 2014;73:177–82.
- 56) Essex MN, Hopps M, Bienen EJ, et al. Evaluation of the relationship between serum uric acid levels and cardiovascular events in patients with gout: a retrospective analysis using electronic medical record data. J Clin Rheumatol 2017;23:160–6.
- 57) Stack AG, Hanley A, Casserly LF, et al. Independent and conjoint associations of gout and hyperuricaemia with total and cardiovascular mortality. QJM 2013;106:647–58.
- 58) Lin H-C, Daimon M, Wang C-H, et al. Allopurinol, benzbromarone and risk of coronary heart disease in gout patients: a population-based study. Int J Cardiol 2017;233:85–90.
- 59) Joo K, Kwon S-R, Lim M-J, et al. Prevention of comorbidity and acute attack of gout by uric acid lowering therapy. J Korean Med Sci 2014;29:657–61.
- 60) Kok VC, Horng J-T, Chang W-S, et al. Allopurinol therapy in gout patients does not associate with beneficial cardiovascular outcomes: a population-based matched- cohort study. PLoS One 2014;9:e99102.
- 61) Kang EH, Choi HK, Shin A, et al. Comparative cardiovascular risk of allopurinol versus febuxostat in patients with gout: a nation-wide cohort study. Rheumatology 2019;58:2122–9.
- 62) White WB, Saag KG, Becker MA, et al. Cardiovascular safety of febuxostat or allopurinol in patients with gout. N Engl J Med 2018;378:1200–10.
- 63) Zhang M, Solomon DH, Desai RJ, et al. Assessment of cardiovascular risk in older patients with gout initiating febuxostat versus allopurinol: population-based cohort study. Circulation 2018;138:1116–26.
- 64) Houben E, Mendel A, Carette S, et al. Predictors of fatal and non-fatal cardiovascular events in ANCA-associated vasculitis: data from the Toronto CanVasc cohort. Joint Bone Spine 2020;87:30006–3.
- 65) Bai YH, ZY L, Chang DY. The BVAS is an independent predictor of cardiovascular events and cardiovascular disease-related mortality in patients with ANCA- associated vasculitis: a study of 504 cases in a single Chinese center. Semin Arthritis Rheum 2018;47:524–9.
- 66) Robson J, Doll H, Suppiah R, et al. Damage in the ANCA-associated vasculitides: long-term data from the European Vasculitis Study Group (EUVAS) therapeutic trials. Ann Rheum Dis 2015;74:177–84.
- 67) de Boysson H, Liozon E, Espitia O, et al. Different patterns and specific outcomes of large-vessel involvements in giant cell arteritis. J Autoimmun 2019;103:102283–83.
- 68) Gale S, Wilson JC, Chia J, et al. Risk associated with cumulative oral glucocorticoid use in patients with giant cell arteritis in real-world databases from the USA and UK. Rheumatol Ther 2018;5:327–40.
- 69) Magder LS, Petri M. Incidence of and risk factors for adverse cardiovascular events among patients with systemic lupus erythematosus. Am J Epidemiol 2012;176:708–19.
- 71) Haque S, Skeoch S, Rakieh C, et al. Progression of subclinical and clinical cardiovascular disease in a UK SLE cohort: the role of classic and SLE-related factors. Lupus Sci Med 2018;5:e000267.
- 77) Nikpour M, Urowitz MB, Ibanez D, et al. Importance of cumulative exposure to elevated cholesterol and blood pressure in development of atherosclerotic coronary artery disease in systemic lupus erythematosus: a prospective proof-of-concept cohort study. Arthritis Res Ther 2011;13:R156.
- 78) Mikdashi J, Handwerger B, Langenberg P, et al. Baseline disease activity, hyperlipidemia, and hypertension are predictive factors for ischemic stroke and stroke severity in systemic lupus erythematosus. Stroke 2007;38:281–5.
- 79) Becker-Merok A, Nossent J, Prevalence NJC. Prevalence, predictors and outcome of vascular damage in systemic lupus erythematosus. Lupus 2009;18:508–15.
- 80) Stojan G, Magder LS, Petri M. Blood pressure variability and age-related blood pressure patterns in systemic lupus erythematosus. J Rheumatol 2020;47:387–93.
- 81) Tselios K, Gladman DD, Su J, et al. Does renin-angiotensin system blockade protect lupus nephritis patients from atherosclerotic cardiovascular events? A case-control study. Arthritis Care Res 2016;68:1497–504.
- 82) Williams B, Mancia G, Spiering W, et al. 2018 ESC/ESH guidelines for the management of arterial hypertension. Eur Heart J 2018;39:3021–104.
- 84) Yu H-H, Chen P-C, Yang Y-H, et al. Statin reduces mortality and morbidity in systemic lupus erythematosus patients with hyperlipidemia: a nationwide population-based cohort study. Atherosclerosis 2015;243:11–18.
- 87) Pons-Estel GJ, González LA, Zhang J, et al. Predictors of cardiovascular damage in patients with systemic lupus erythematosus: data from LUMINA (LXVIII), a multiethnic US cohort. Rheumatology 2009;48:817–22.
- 88) Fernández-Nebro A, Rúa-Figueroa Íñigo, López-Longo FJ, et al. Cardiovascular events in systemic lupus erythematosus: a nationwide study in Spain from the RELESSER registry. Medicine 2015;94:e1183.
- 92) Hinojosa-Azaola A, Romero-Diaz J, Vargas-Ruiz AG, et al. Venous and arterial thrombotic events in systemic lupus erythematosus. J Rheumatol 2016;43:576–86.
- 93) Ibañez D, Gladman DD, Urowitz MB. Adjusted mean systemic lupus erythematosus disease activity Index-2K is a predictor of outcome in SLE. J Rheumatic 2005;32:824–7.
- 94) Fasano S, Margiotta DP, Gualtierotti R, et al. The incidence of cardiovascular events in Italian patients with systemic lupus erythematosus is lower than in North European and American cohorts: implication of disease-associated and traditional risk factors as emerged by a 16-year retrospective GIRRCS study: GIRRCS=Gruppo Italiano di Ricerca in Reumatologia clinica E Sperimentale. Medicine 2018;97:e0370.
- 95) Tselios K, Gladman DD, Su J, et al. Evolution of risk factors for atherosclerotic cardiovascular events in systemic lupus erythematosus: a longterm prospective study. J Rheumatol 2017;44:1841–9.
- 96) Goldberg RJ, Urowitz MB, Ibañez D, et al. Risk factors for development of coronary artery disease in women with systemic lupus erythematosus. J Rheumatol 2009;36:2454–61.
- 97) Urowitzx MB, Ibañez D, Gladman DD. Atherosclerotic vascular events in a single large lupus cohort: prevalence and risk factors. J Rheumatology 2007;34:70–5.
- 98) Chen H-L, Shen L-J, Hsu P-N, et al. Cumulative burden of glucocorticoid-related adverse events in patients with systemic lupus erythematosus: findings from a 12-year longitudinal study. J Rheumatol 2018;45:83–9.
- 100) Siricheepchaiyan W, Narongroeknawin P, Pakchotanon R, et al. Lupus damage and waist circumference as the independent risk factors for cardiovascular disease in SLE patients from Phramongkutklao Hospital. J Med Assoc Thai 2016;99:290–300.
- 101) Fasano S, Margiotta DPE, Pierro L, et al. Prolonged remission is associated with a reduced risk of cardiovascular disease in patients with systemic lupus erythematosus: a GIRRCS (Gruppo Italiano di Ricerca in Reumatologia clinica E Sperimentale) study. Clin Rheumatol 2019;38:457–63.
- 102) Ruiz-Arruza I, Lozano J, Cabezas-Rodriguez I, et al. Restrictive use of oral glucocorticoids in systemic lupus erythematosus and prevention of damage without worsening long-term disease control: an observational study. Arthritis Care Res 2018;70:582–91.
- 103) Mok CC, Tong KH, To CH, et al. Risk and predictors of arterial thrombosis in lupus and non-lupus primary glomerulonephritis: a comparative study. Medicine 2007;86:203–9.
- 104) Szalai AJ, Alarcón GS, Calvo-Alén J, et al. Systemic lupus erythematosus in a multiethnic US cohort (LUMINA). XXX: association between C-reactive protein (CRP) gene polymorphisms and vascular events. Rheumatology 2005;44:864–8.
- 106) Gustafsson J, Gunnarsson I, Börjesson O, et al. Predictors of the first cardiovascular event in patients with systemic lupus erythematosus – a prospective cohort study. Arthritis Res Ther 2009;11:R186.
- 107) Martinez-Berriotxoa A, Ruiz-Irastorza G, Egurbide M-V, et al. Transiently positive anticardiolipin antibodies and risk of thrombosis in patients with systemic lupus erythematosus. Lupus 2007;16:810–6.
- 108) Bessant R, Duncan R, Ambler G, et al. Prevalence of conventional and lupus-specific risk factors for cardiovascular disease in patients with systemic lupus erythematosus: a case-control study. Arthritis Rheum 2006;55:892–9.

今回はここまでです。最後までお読み頂きありがとうございました。ご参考になりましたら幸いです? Twitterでのいいねやフォローをして頂けますと励みになりますので、ぜひよろしくお願いします?
リンク
※個人個人で症状の違いがあるため、詳細な治療などにつきましては直接医療機関へお問い合わせください。